Иммунная система для смертных: 8 вопросов и ответов
Год назад я зачем-то купил и прочитал книгу об иммунной системе. Я особо ни на что не надеялся, когда её покупал, но оказалось, что книга написана блестяще. Автору удается довольно кратко и понятно объяснить основные механизмы и принципы работы одной из самых сложных систем нашего организма. Почему-то в русскоязычных учебниках всё любят усложнять. Поэтому мне захотелось написать небольшой материал по мотивам книги.
В этой статье я хочу дать вам почувствовать, что такое иммунная система и как она решает довольно сложные вопросы. Тут не будет большого количества деталей, лишь некоторые общие принципы и паттерны. Детали, при желании, вы найдёте сами.
Для начала, небольшой обзор и главные действующие лица. Познакомимся с патогенами, ограничившись вирусами и бактериями.
Патогены
Патоген — это микроорганизм, который способен вызвать болезнь.
Вирусы
Вирусы — очень маленькие патогены (гораздо меньше клеток), и многие ученые считают, что вирусы существуют на границе живого и неживого. Они не могут размножаться вне клеток.
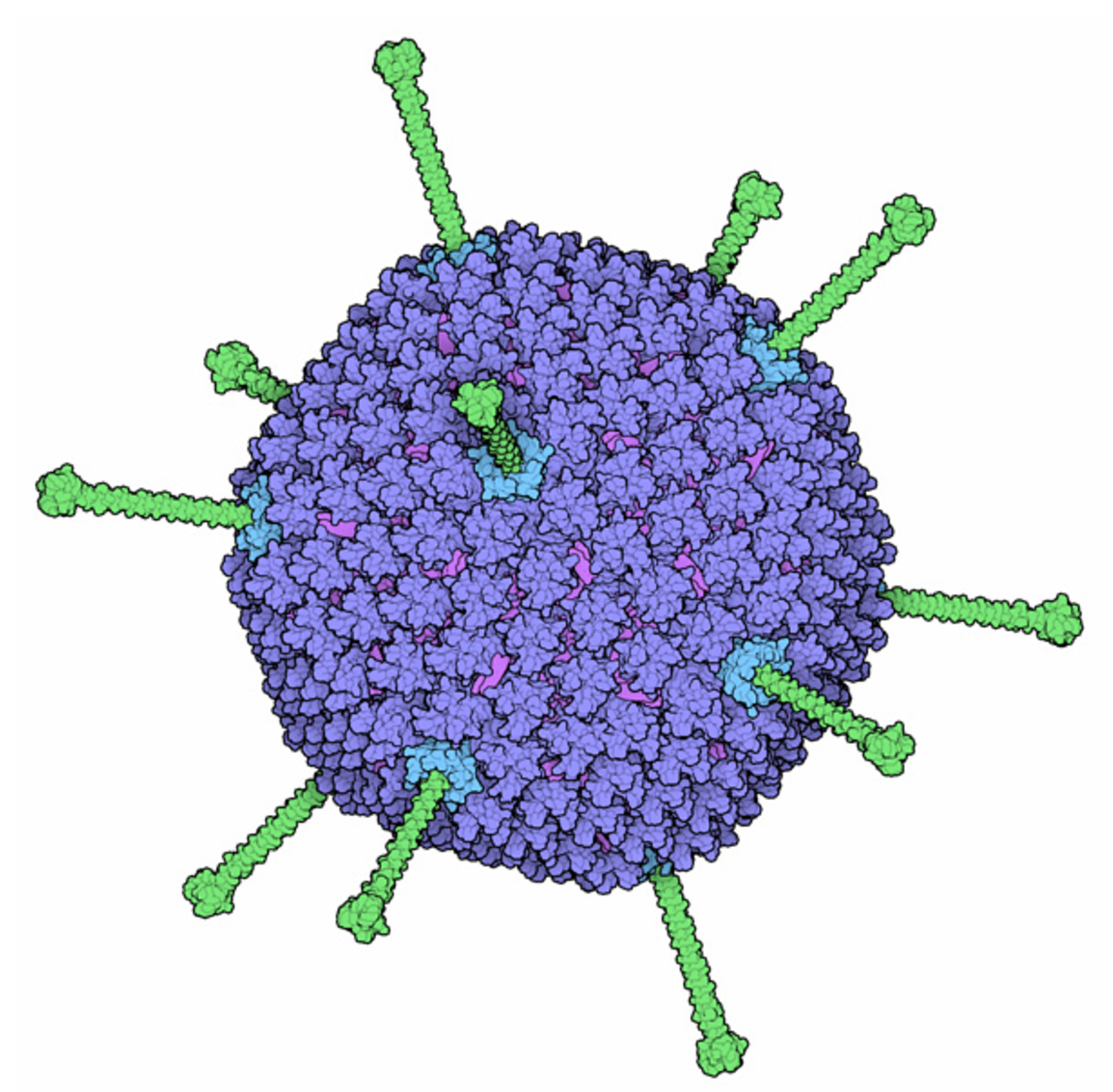 Аденовирус. Насморк, красные глаза, температура, все дела.
Аденовирус. Насморк, красные глаза, температура, все дела.
Цель вируса — проникнуть внутрь клетки, преодолев все защитные барьеры, и наладить там конвейерную линию производства самого себя, используя индустриальные мощности клетки. Обычно клетка потом разрушается.
Бактерии
Бактерии чаще всего представляют собой одноклеточные организмы. Они гораздо больше вирусов и обычно живут вне клеток человеческого организма (хотя некоторые могут забираться и внутрь).
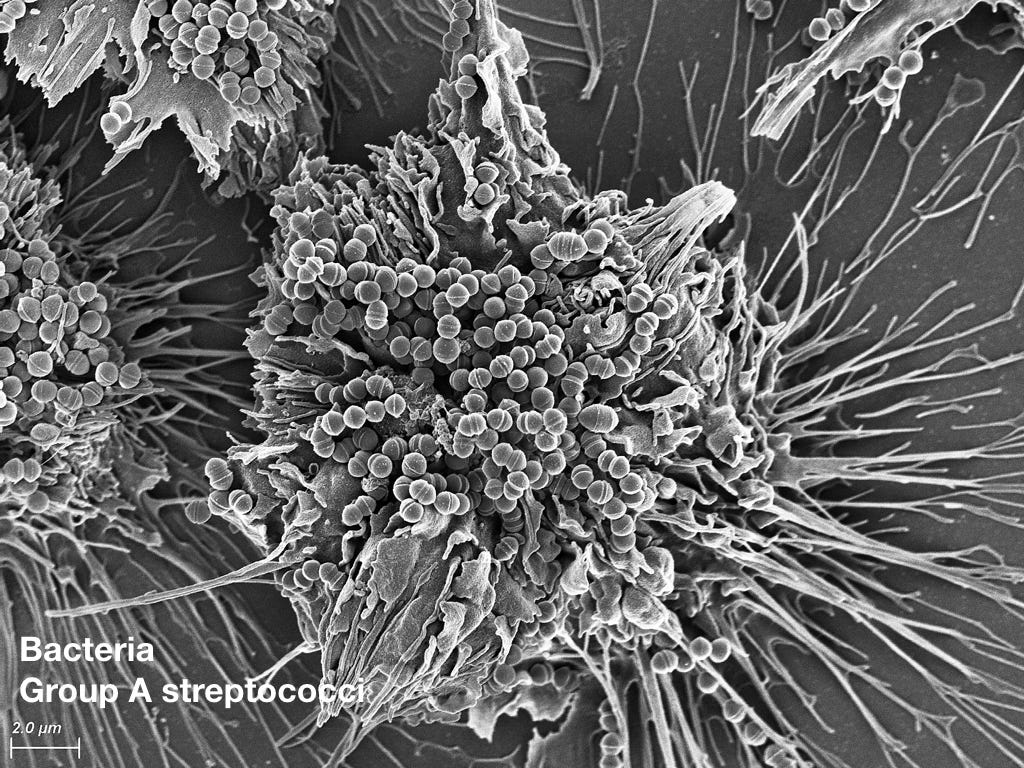 Стрептококки оккупировали миндалины. Боль в горле и так далее.
Стрептококки оккупировали миндалины. Боль в горле и так далее.
В организме человека бактерии конкурируют за полезные вещества (например, железо). Бактерии частенько убивают наши клетки в погоне за чем-то питательным. Кроме того, они выделяют токсины как побочный продукт своей жизнедеятельности. Короче, малоприятные существа.
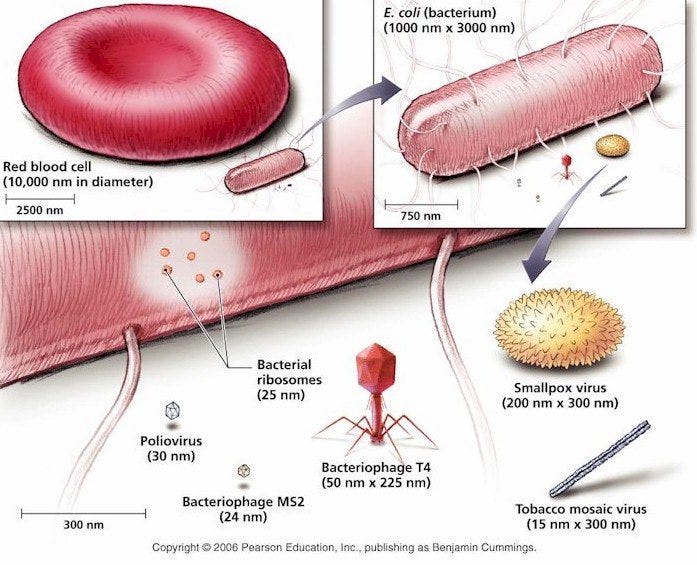
Наверняка у вас возник вопрос: насколько вирусы меньше бактерий? Гораздо меньше. На картинке снизу бактерия E. coli во много раз меньше эритроцита, ну а вирусы совсем крохотные даже по сравнению с бактерией.
Краткий обзор иммунной системы
С патогенами мы кратко познакомились, теперь посмотрим на защитников нашего организма.
I. Врождённая иммунная система
В левом верхнем углу агрессивно настроенная бактерия проникает через небольшую ранку в коже и встречается с неприветливым внутренним миром человеческого организма. Для начала она имеет дело с врождённой иммунной системой (innate system):
Главная особенность врождённой иммунной системы — быстрая реакция.
Помните книгу Канемана Thinking, Fast and Slow? Там тоже были две системы в мозге, быстрая интуитивная и медленная аналитическая. Иммунная система устроена похожим образом. Врождённая иммунная система реагирует быстро, но не способна в одиночку справиться с некоторыми патогенами. Адаптивная иммунная система реагирует медленно, но зато способна справиться практически с любым противником.
Врождённая иммунная система обладает приличным арсеналом для встречи вредных бактерий и вирусов (все это в левой части рисунка):
- Фагоциты (в частности, макрофаги / macrofage, которые умеют кушать бактерии)
- Система комплемента / complement (белковые молекулы, которые умеют делать в бактериях дырки)
- Натуральные киллеры / NK-cell (лимфоциты, которые умеют впрыскивать в бактерии разрушающие химические вещества)
Пока представим себе, что бактерию обнаружил и скушал злой макрофаг. Он очень умный парень и запускает сигнал тревоги — выбрасывает в окружающее пространство сигнальные белки: цитокины. Они попадают в кровь, и к месту инфекции из крови мигрируют лейкоциты. Бактерий обычно много, а макрофаги могут скушать несколько десятков, пока им не надоест. Поэтому нужны более многочисленные боевые соединения, а лейкоциты именно такие.
Сначала с инфекцией сталкивается малочисленный авангард, потом подтягиваются основные войска, а потом уже включается медленная, но тяжелая артиллерия.
Фагоцит
Довольно здоровая клетка врождённой иммунной системы, которая поглощает бактерии, нехорошие клетки и всякие отходы жизнедеятельности. Чем-то напоминает амебу.
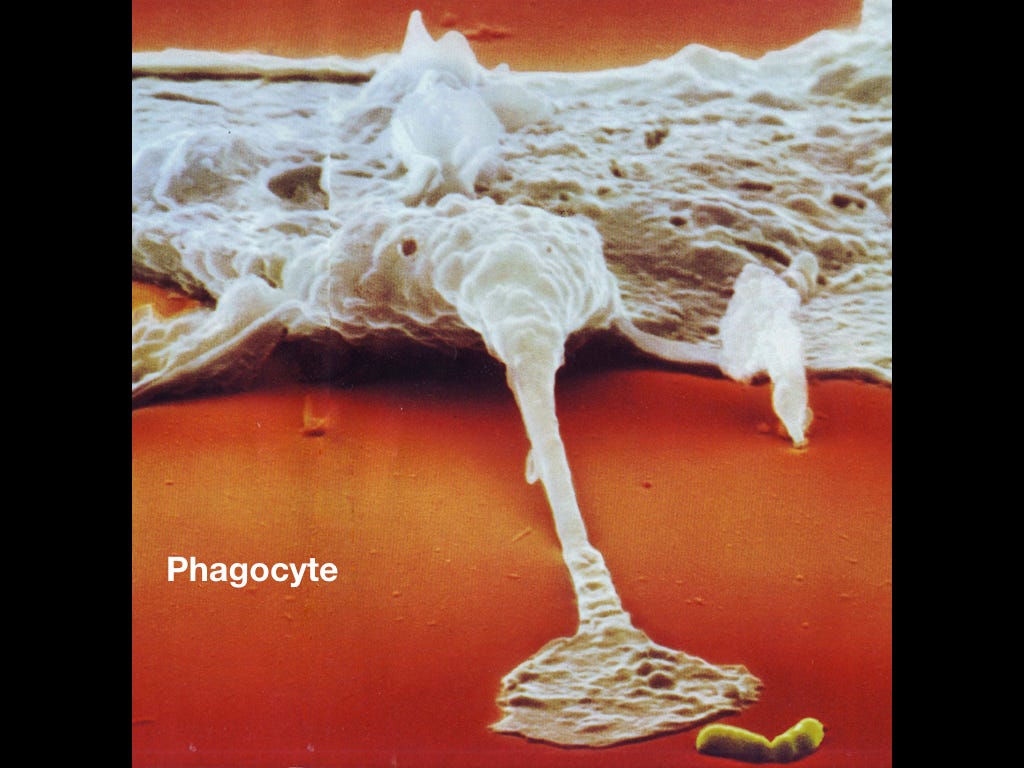 Фагоцит тянется ложноножкой к обреченной бактерии
Фагоцит тянется ложноножкой к обреченной бактерии
Система комплемента
Сложный комплекс белковых молекул. Он может прикрепляться к бактериям и делать в них дырки. Кажется, как это может быть? Почему они не делают дырки в других местах, например, в клетках организма? Ответ на этот вопрос будет дан чуть позже.
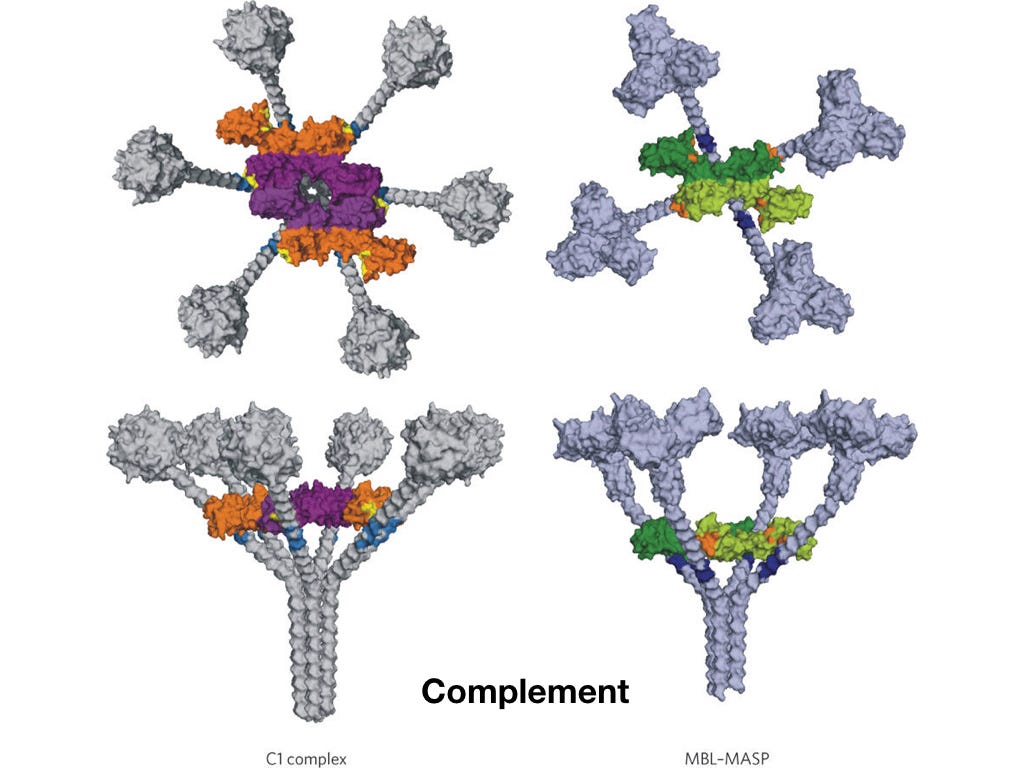 Я раньше и представить себе не мог, что белковые молекулы способны на такое.
Я раньше и представить себе не мог, что белковые молекулы способны на такое.
Натуральный киллер (NK)
Лимфоцит врождённой иммунной системы, который в основном уничтожает клетки, зараженные вирусами.
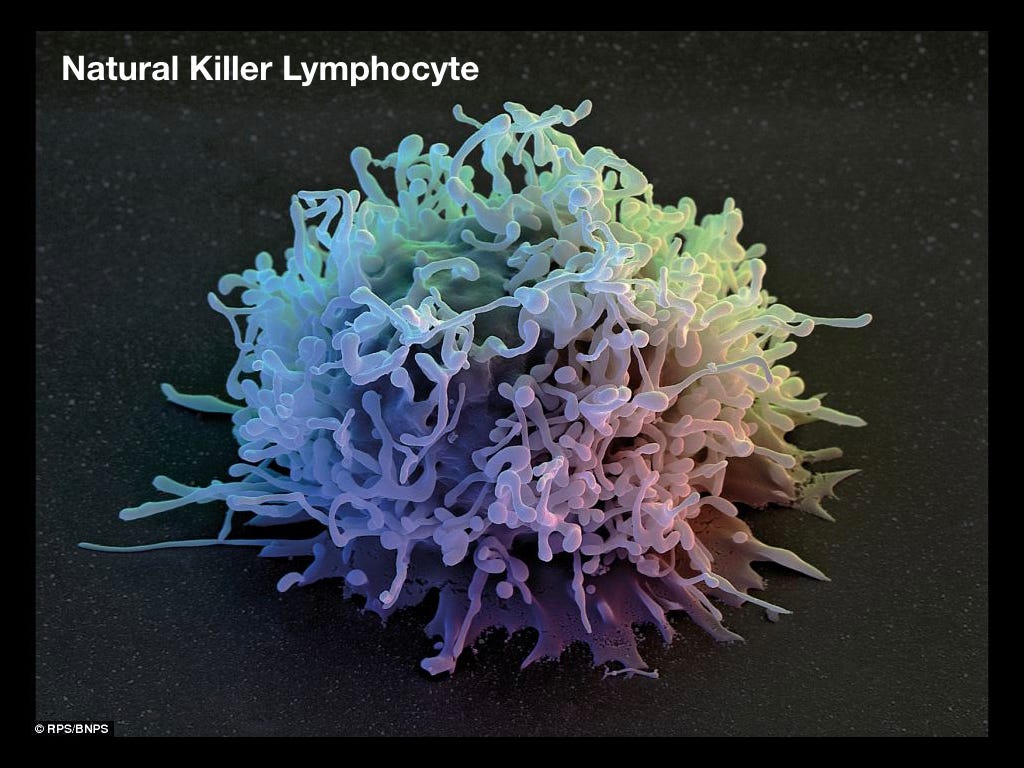 NK-cell. Цвета для красоты.
NK-cell. Цвета для красоты.
Лейкоциты
Белые кровяные тельца (нейтрофилы и прочие). Умеют поглощать патогены и даже создавать невероятные ловушки для них.
).](https://cdn-images-1.medium.com/max/2000/1*DJbel0A7QziLae6fcb04EQ.jpeg) Капилляр с эритроцитами и лейкоцитами. Да, именно так выглядит кровь человека (в данном случае не слишком здорового).
Капилляр с эритроцитами и лейкоцитами. Да, именно так выглядит кровь человека (в данном случае не слишком здорового).
Антигенпрезентующие клетки (APC)
Самый важный из антигенпрезентующих клеток — это дендритные клетки. APC умеют выставлять наружу и показывать всем желающим антигены. Антигены попадаются не всегда. Грубо говоря, APC выставляет наружу пептиды, которые являются кусками вируса или бактерии.
Можно сказать, APC являются основным связующим звеном между двумя иммунными подсистемами.
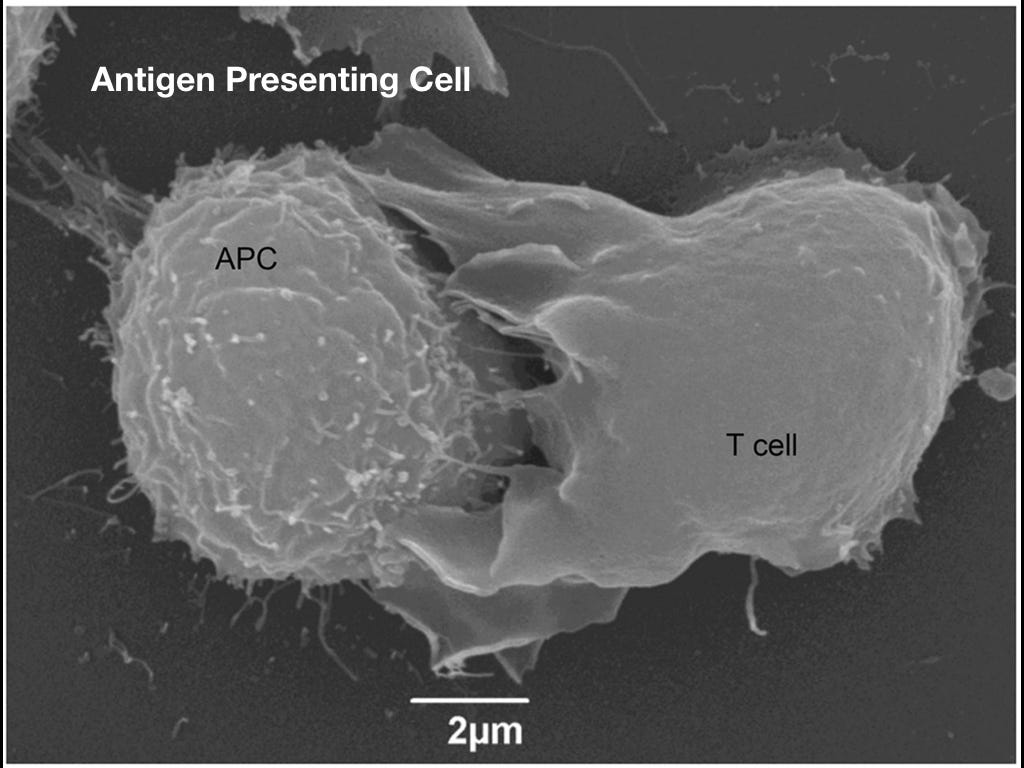 Антигенпрезентующая клетка (слева) показывает T-лимфоциту, что у неё есть.
Антигенпрезентующая клетка (слева) показывает T-лимфоциту, что у неё есть.
Цитокины
Сигнальные белковые молекулы, с помощью которых информация о воспалении или инфекции распространяется куда попало.
 (IL-1). Сигнальный белок.](https://cdn-images-1.medium.com/max/2000/1*wyIYrE7UUgNkJPRNTglgKw.jpeg) Интерлейкин 1 (IL-1). Сигнальный белок.
Интерлейкин 1 (IL-1). Сигнальный белок.
II. Адаптивная иммунная система
Адаптивная иммунная система (adaptive system) работает гораздо медленнее (и сложнее). Очень кратко механизм её работы в правой части рисунка. Я постараюсь дать общее представление без огромного количества специальных терминов.
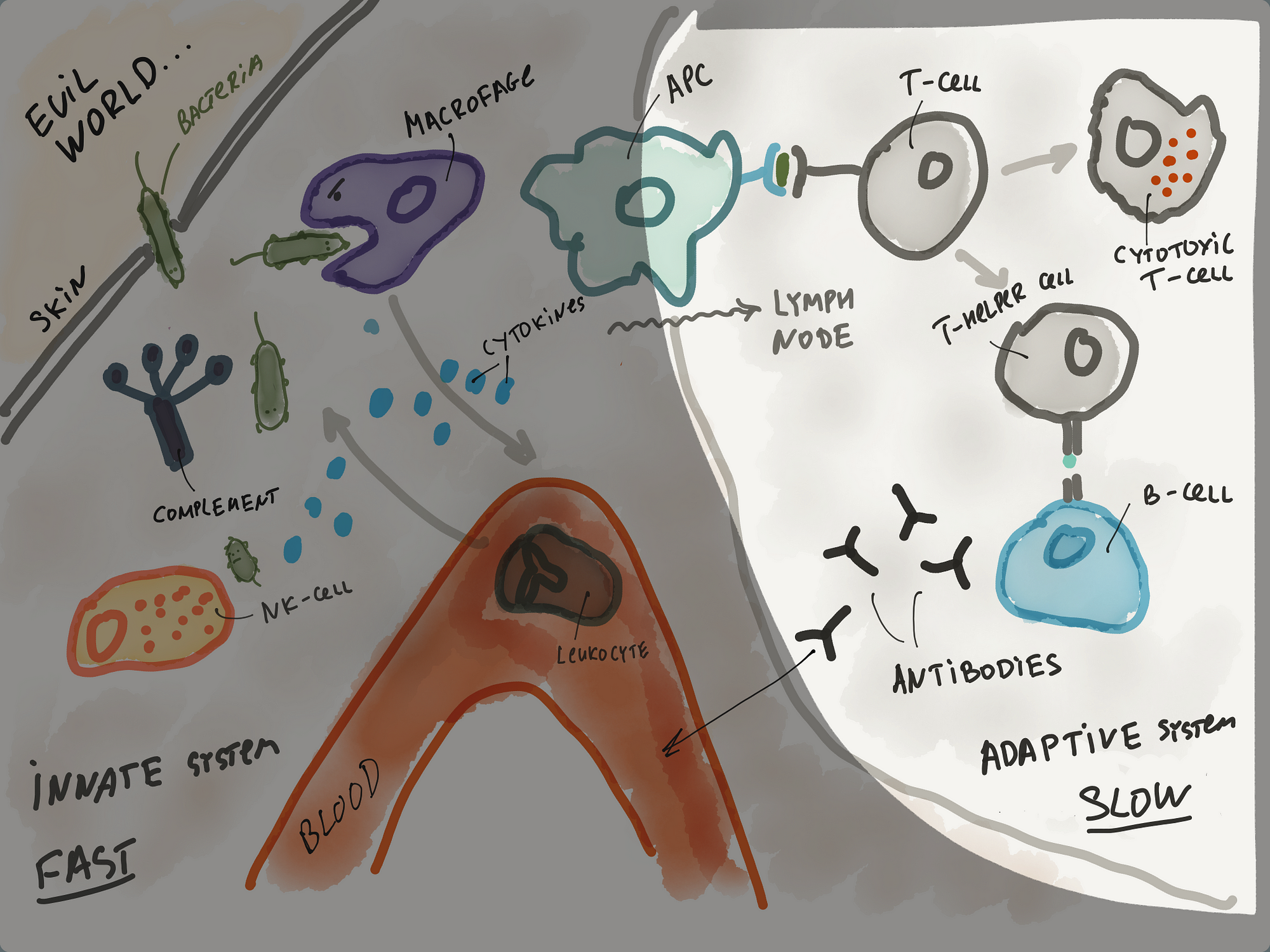
Для начала, антигенпрезентующие клетки иммунной системы (APC) берут куски патогена и путешествуют в лимфоузлы, где встречаются с T-лимфоцитами / T-cell. При встрече они говорят “гляди, чего у меня есть!”. T-лимфоциты видят, что кусок патогена не является родной частью организма, и превращаются в один из двух видов:
- либо в Т-киллеры (cytotoxic T-cell, которые умеют убивать)
- либо в Т-хелперы (T-helper cell, которые активируют B-лимфоциты / B-cell).
B-лимфоциты умеют производить огромное количество антител / antibody). Антитела доставляются к месту инфекции и очень сильно помогают другим клеткам иммунной системы обнаруживать и уничтожать патогены. Процесс выработки антител не сильно быстрый, концентрация достигает пика дней через 10–15.
Т-киллеры
Лимфоциты адаптивной иммунной системы, которые также уничтожают клетки организма, с которыми не все в порядке.
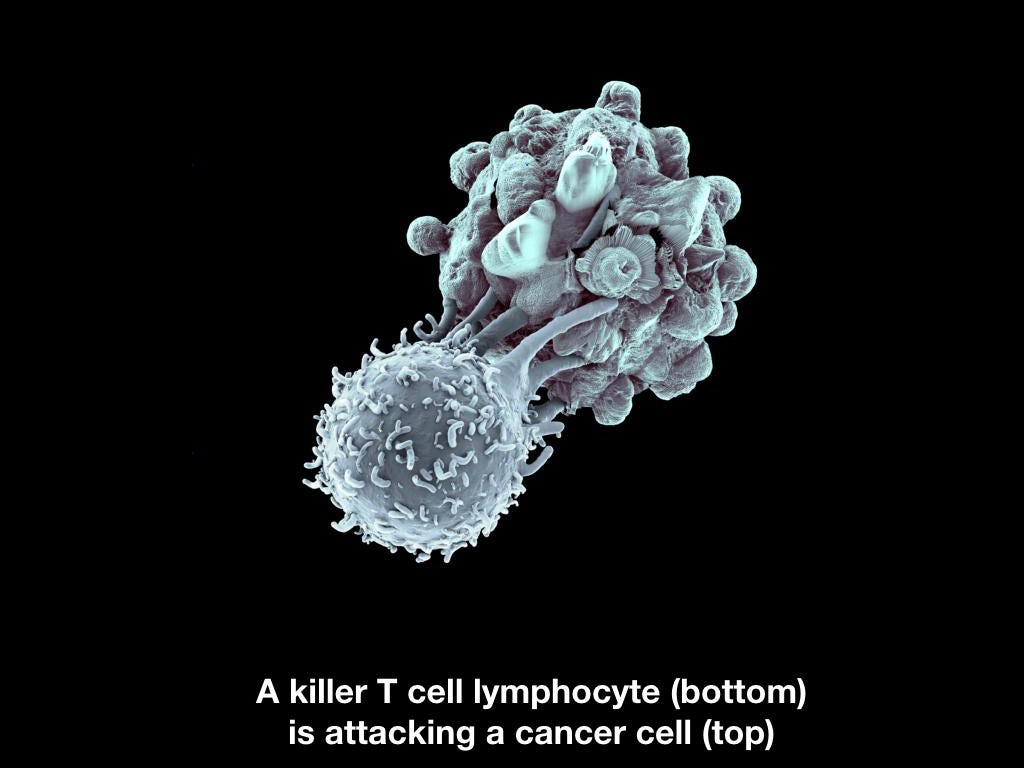 Красивый Т-киллер уничтожает некрасивую раковую клетку.
Красивый Т-киллер уничтожает некрасивую раковую клетку.
B-лимфоциты
Клетки адаптивной иммунной системы, которые умеют производить антитела (о них чуть ниже). Разнообразие производимых антител огромно (~100 миллионов видов), поэтому наш организм в принципе может справиться с большинством патогенов. Если же по причине мутации разнообразие снижается хотя бы на порядок, то для человека все очень плохо.
 B-лимфоцит во всей красе. Ну в целом ничего особенного, но я должен был вам его показать.
B-лимфоцит во всей красе. Ну в целом ничего особенного, но я должен был вам его показать.
Кроме того, после перенесенной инфекции некоторая часть специфичных к ней B-лимфоцитов надолго остается в организме, значительно ускоряя иммунный ответ в случае повторного заражения этой же инфекцией.
Антитела
Белковые молекулы, которые синтезируются B-лимфоцитами. Обычно человеческий организм умеет синтезировать 100 миллионов разных антител—это огромное разнообразие необходимо для распознавания постоянно меняющихся вирусов и прочих патогенов.
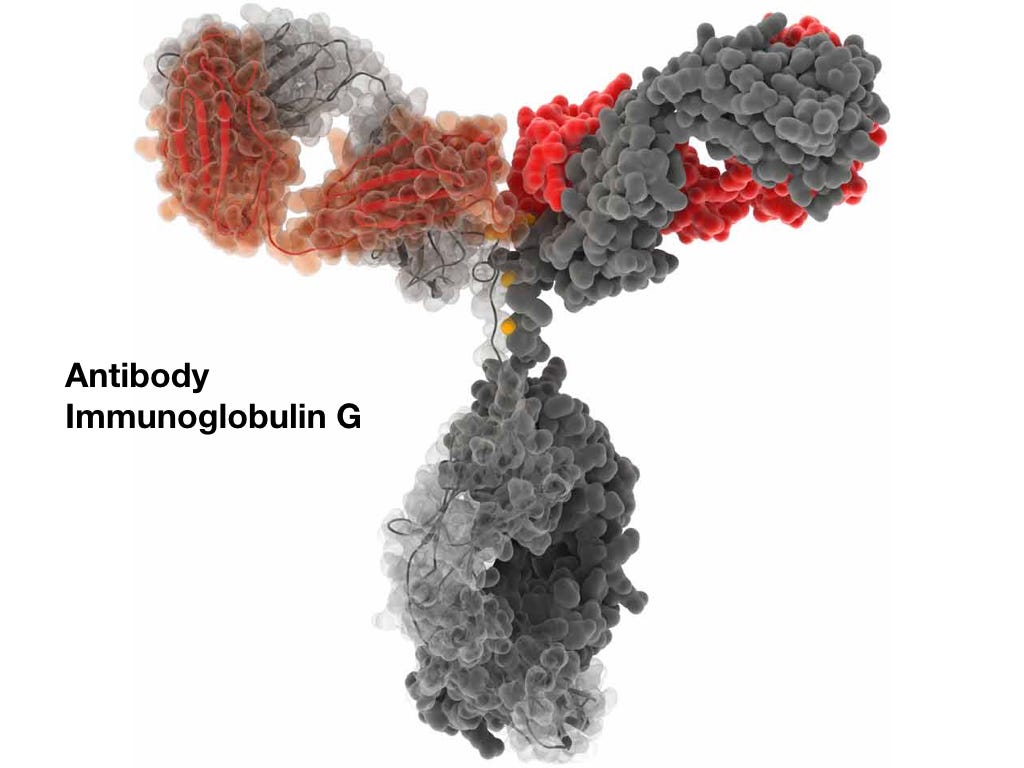 Иммуноглобулин G. Наиболее распространенный в организме. Умеет прикрепляться к бактериям, вирусам и грибкам.
Иммуноглобулин G. Наиболее распространенный в организме. Умеет прикрепляться к бактериям, вирусам и грибкам.
Почему у нас нет иммунитета, например, к ОРВИ? На самом деле он есть, просто эти вирусы очень быстро мутируют, поэтому помнящие вирус B-лимфоциты совершенно бесполезны. Организму приходится запускать процесс заново при контакте с новым подвидом вируса. Зато мы редко болеем дважды одним и тем же конкретным подвидом вируса именно благодаря B-лимфоцитам с правильными антителами. Два раза болеть гриппом за зиму —это было бы уже слишком!
Будем считать, что вы немного знакомы со действующими лицами и уже окончательно запутались.
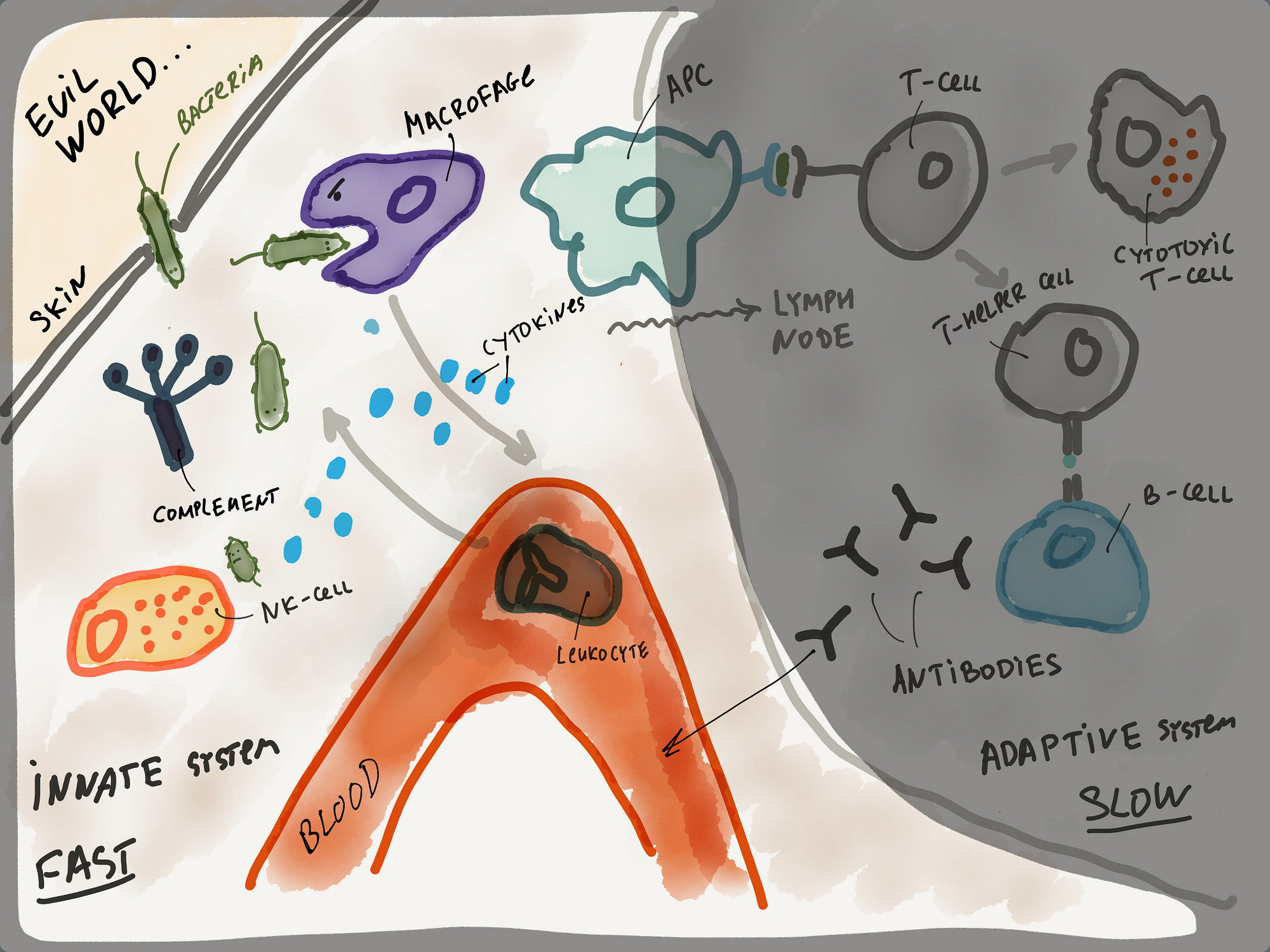
Вот угрожающая общая картинка, которая должна быть понятна.
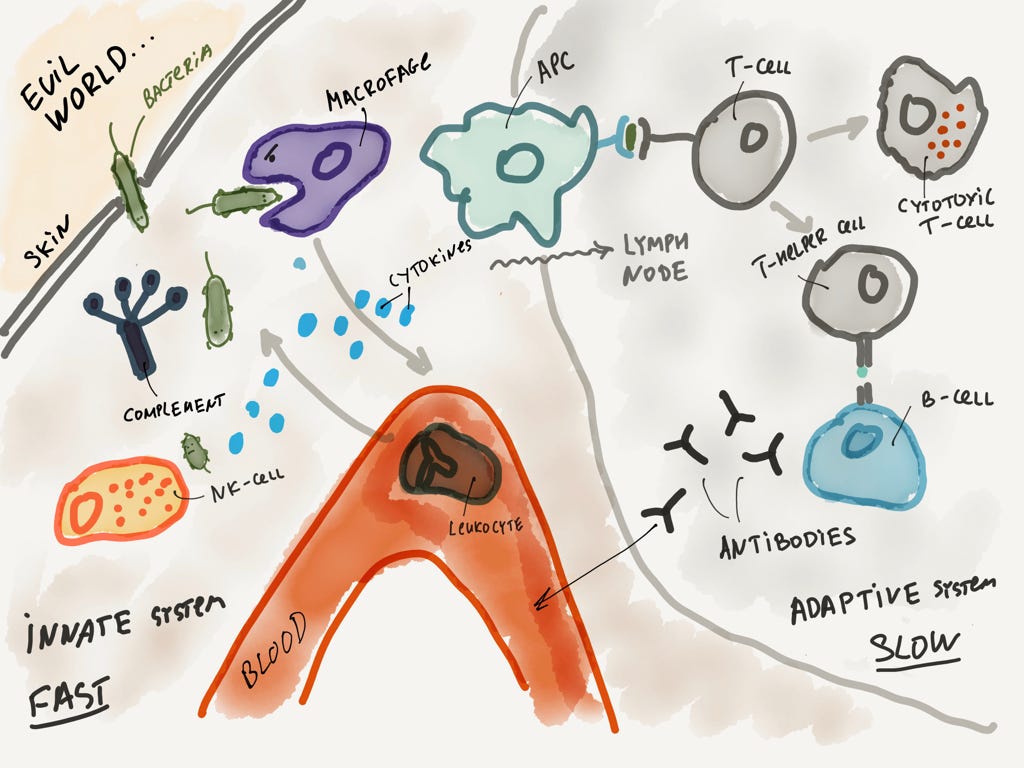 Слева — основные компоненты врождённой иммунной системы. Справа — адаптивной иммунной системы.
Слева — основные компоненты врождённой иммунной системы. Справа — адаптивной иммунной системы.
Я пройдусь по всему процессу еще раз очень кратко. Патоген попадает внутрь организма и его всеми способами атакует врождённая иммунная система (фагоциты, лейкоциты, система комплемента). Информаци о патогене попадает в специальные органы (например, лимфоузлы посредством антигенпрезентующих клеток), где с ней активно знакомятся клетки адаптивной иммунной системы (T-лимфоциты). Запускается производство антител посредством B-лимфоцитов. Антитела приходят на помощь и значительно упрощают работу врождённой иммунной системе.
Начнем распутывать этот клубок, задавая очень разумные и простые вопросы.
#1. Как организм отличает свои клетки от чужих?
Действительно, многообразие нужных и полезных штук в организме огромное. Как отличить своё от чужого? Для начала разберемся с бактериями.
Вот гуляет по нашему телу фагоцит и вступает в контакт с разными бактериями. Некоторые полезные и нужные, но некоторые подлежат уничтожению.
Оказывается, фагоциты и бактерии активно участвуют в гонке вооружений. Фагоциты стремятся отрастить рецепторы, которые распознают критически важные и специфичные для вредных бактерий молекулы. Бактерии стремятся избавиться от этих специфичных молекул и заменить их чем-то другим, чтобы рецепторы перестали работать.
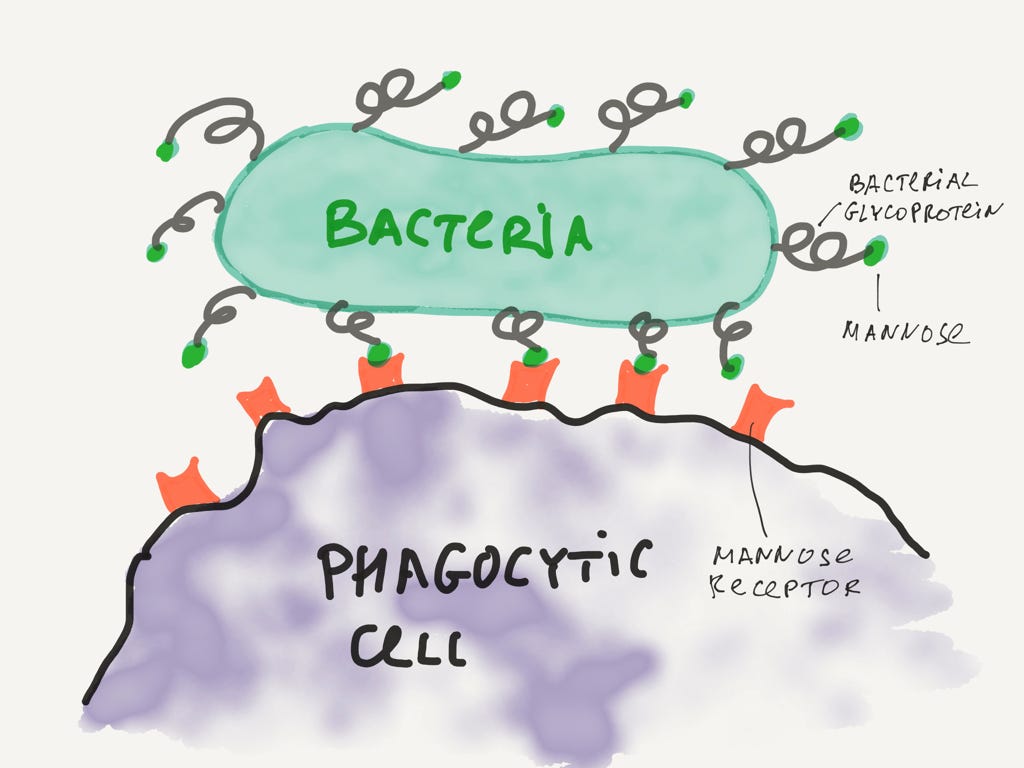 Фагоцит обнаруживает вредную бактерию.
Фагоцит обнаруживает вредную бактерию.
В данном случае фагоцит успешно распознает маннозу, которая входит в состав гликопротеинов многих бактерий. Как оказалось, бактерии не так-то просто избавиться от этого компонента мембраны, и эту бактерию фагоцит успешно уничтожит. Очевидно, что у полезных бактерий такого компонента мембраны нет.
#2. Как организм узнает, что у клетки проблемы внутри?
Ну хорошо, снаружи есть рецепторы и это довольно просто. Но как распознать патоген, которые забрался внутрь клетки и там творит свои темные дела под покровом клеточной мембраны?
Если очень кратко, то процесс работает так. Внутри клетки есть штуки, которые постоянно дробят на мелкие кусочки всё, что попадается под руку. Эти мелкие кусочки клетка выставляет наружу на обозрение всем заинтересованным лицам через специальный комплекс белковых молекул (MHC). Заинтересованные лица (например, T-киллер) смотрят на эти куски в поисках антигенов. Если антиген совпадает с рецептором, то сразу становится ясно, что внутри клетки происходит что-то нехорошее. Ну а если не совпадает, то клетка считается здоровой.
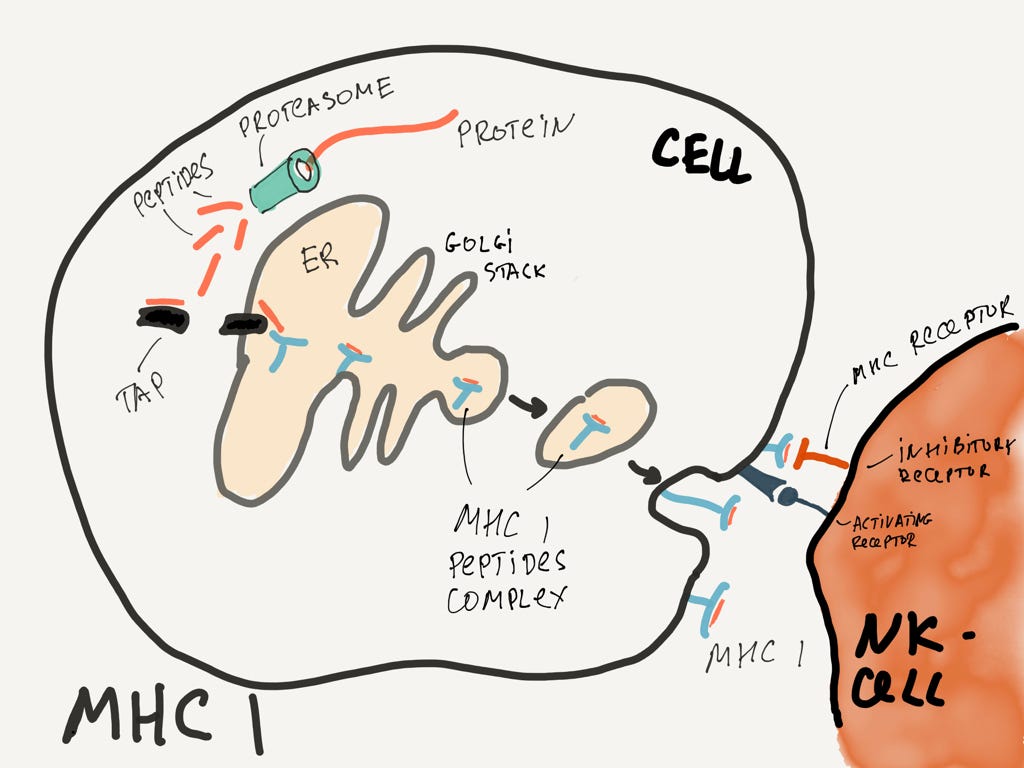 Сложный процесс демонстрации клеткой своих внутренностей.
Сложный процесс демонстрации клеткой своих внутренностей.
Для дотошных более подробно. В процессе жизнедеятельности в клетке образуются протеины, куски протеинов и прочие цепочки аминокислот. Ну там собралось что-то неправильно, или вирус разрушился и его остатки там плавают. Эти остатки рано или поздно попадают в протеасому, которая безжалостно рубит их в мелкие пептиды. Далее, транспортный белок TAP берет эти пептиды и тащит в эндоплазматический ретикулум. В нём пептид сгружается на MHC (главный комплекс гистосовместимости), который в пузырьке благополучно доставляется на поверхность клетки и встраивается в мембрану.
Таким образом, клетка постоянно демонстрирует своё содержимое наружу через MHC. Природа заложила каналы для мониторинга клеток!
К сожалению, некоторые вирусы умеют блокировать MHC (или сильно уменьшать их количество, уменьшая вероятность обнаружения проблем). С этими хитрецами умеют бороться натуральные киллеры. Раз на поверхности нет MHC, то клетку можно считать нездоровой и ликвидировать её. Очень элегантно.
#3. Как организм производит такое многообразие антител?
Пожалуй, самый сложный для объяснения вопрос. Для начала разберемся чуть более подробно, что же такое антиген.
Антиген — любое вещество, которое организм считает чужеродным. Таких веществ огромное количество, как можно себе представить. Поэтому организму необходимо уметь производить около 100 миллионов разновидностей антител, чтобы уметь распознавать все эти антигены.
Антитела (antibody) в целом похожи, но у них есть часть, которая весьма разнообразна. Собственно эта часть и умеет распознавать антигены.
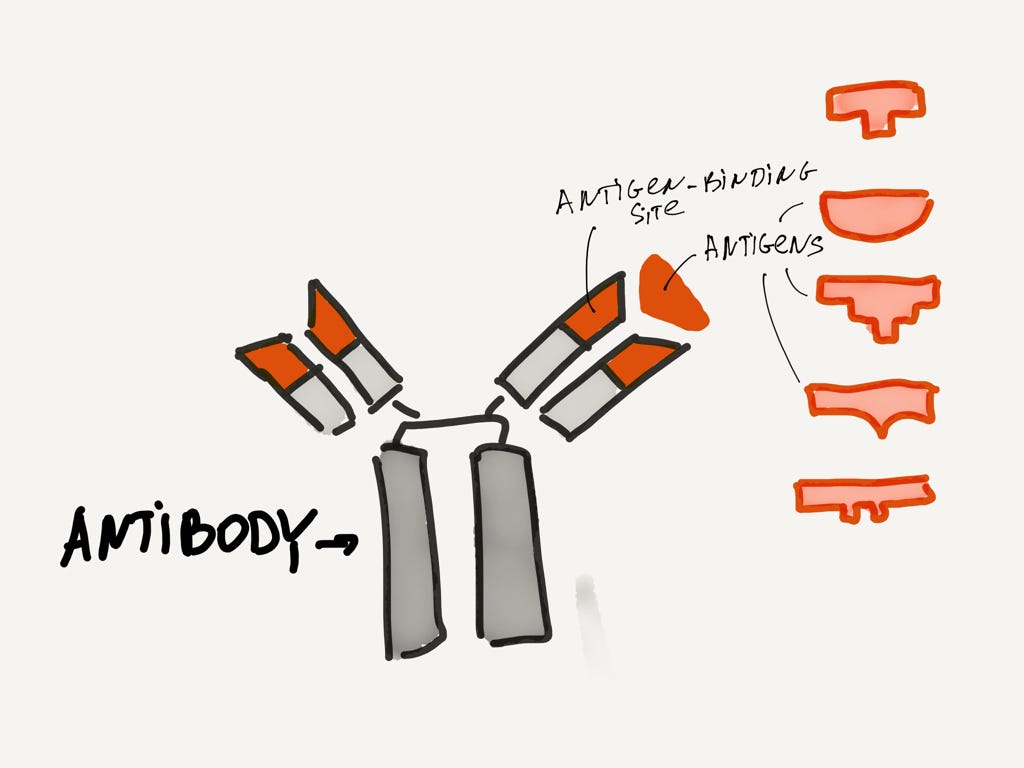 Антитело со стабильной частью (серым) и вариабельной частью (красным).
Антитело со стабильной частью (серым) и вариабельной частью (красным).
Ну хорошо, а зачем нам антитела? Это всего лишь белковые молекулы, на что они способны? У антител есть главная задача: прикрепляться к патогенам (этот процесс называется специальным словом опсонизация) и сигнализировать клеткам иммунной системы о том, что “вот я тут прикрепился к чему-то нехорошему, это можно уничтожать”. Кроме того, бактерии, облепленные антителами, теряют подвижность, что облегчает фагоцитам охоту за ними.
Антитела радикально помогают клеткам иммунной системы обнаруживать и уничтожать патогены. Без них мы бы все давно умерли.
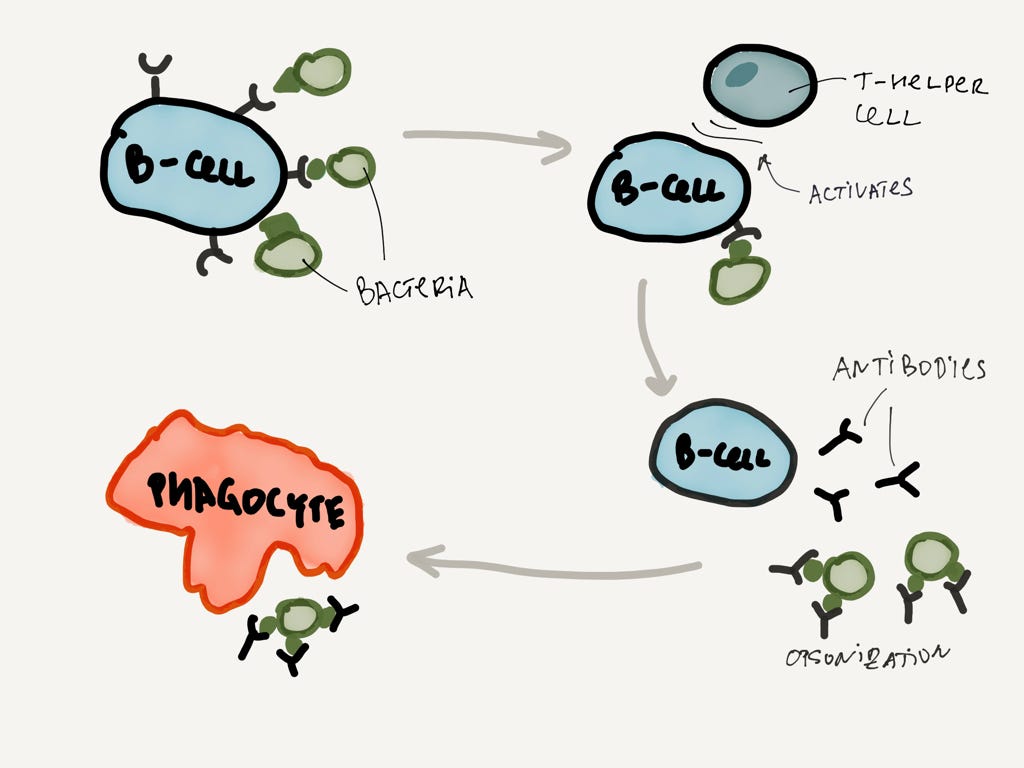 B-лимфоцит обнаруживает бактерию с подходящим антигеном, активируется, и начинает бешено производить антитела (со скоростью 2000 штук в секунду!)
B-лимфоцит обнаруживает бактерию с подходящим антигеном, активируется, и начинает бешено производить антитела (со скоростью 2000 штук в секунду!)
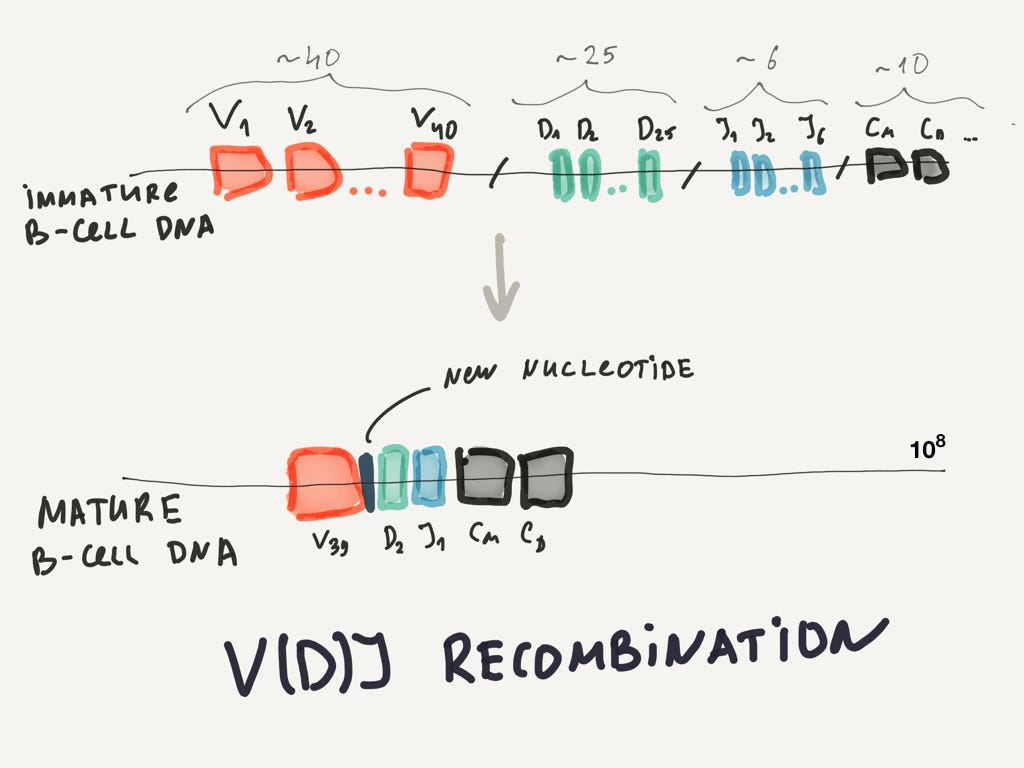
Переходим к самой сложной части. Напомню, виды белков, которые может синтезировать клетка, закодированы в ДНК. Как нам получить 100 миллионов разных конфигураций антител? Кодировать это все в ДНК совершенно невозможно, потому что она станет неприлично большой. В дело вступает крайне элегантный процесс модульного дизайна, который называется V(D)J-рекомбинацией.
Антитела производятся зрелыми B-лимфоцитами. B-лимфоциты бывают незрелые (immature) и зрелые (mature). Так вот ДНК отдельно взятого зрелого B-лимфоцита собирается из произвольно выбранных кусков ДНК незрелого B-лимфоцита.
 Всё сложно.
Всё сложно.
V, D, J и C — это сегменты генов в ДНК. Например V сегмент имеет 40 различных копий самого себя, которые немного отличаются друг от друга. D — 25 копий, и так далее. Вы можете считать все эти копии модулями. Когда строится ДНК зрелой клетки, эти модули берутся случайным образом и склеиваются друг с другом. Данного разнообразия всё равно недостаточно, поэтому в этот кусок ДНК встраиваются случайные нуклеотиды, которые увеличивают разнообразие еще на один порядок.
К сожалению, эти случайные вставки в 90% случаев приводят к нефункциональной B-клетке, которая уничтожается организмом. Так что выживает только 10% B-клеток. Процесс рекомбинации довольно дорогой, как вы видите. Приходится избавляться от большого количества брака. Зато это прекрасный образец модульного дизайна и порождения разнообразия из малого объема хранимой информации!
Дальше будет только проще. Мы перевалили через вершину.
#4. Как распространяется сигнал от места инфекции?
Представьте, что вы лейкоцит и вас носит по капиллярам и артериям с довольно приличной скоростью. И вот где-то на периметре атака бактерий! Ваша задача выйти из капилляра и ринуться на помощь. Как это сделать?
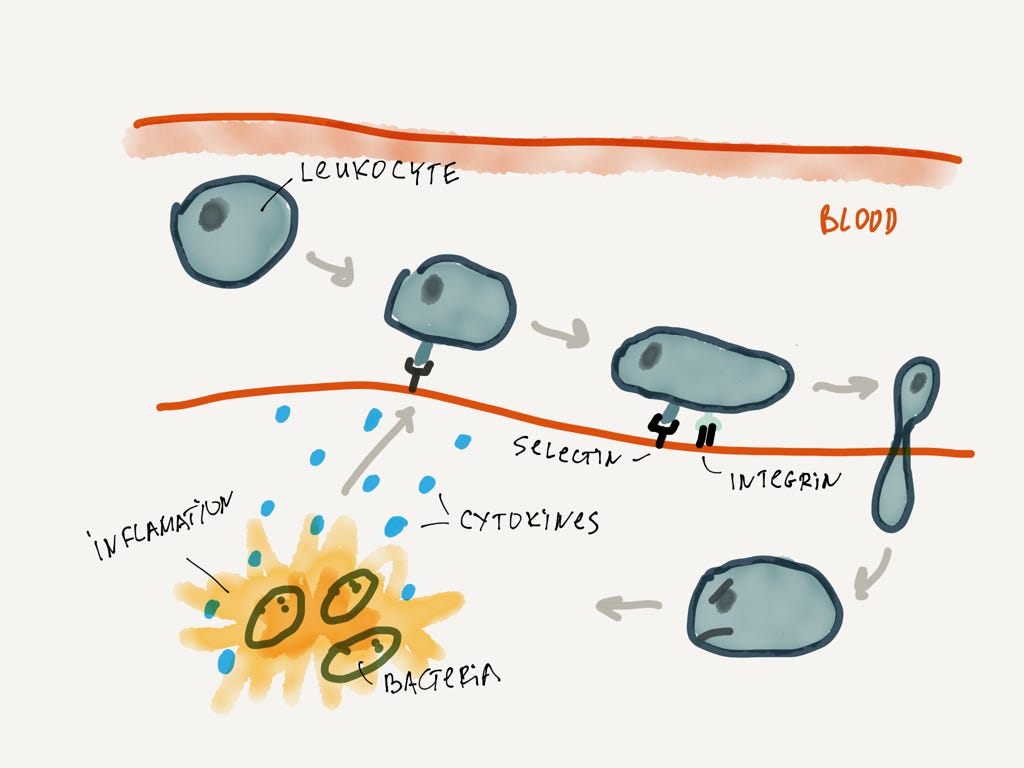 Выход лейкоцитов из крови;
Выход лейкоцитов из крови;
Допустим, бактерии уже обнаружены макрофагами, они скушали десяток бактерий и сигнализировали цитокинами о том, что всё не очень хорошо. Цитокины распространяются во всех направлениях и рано или поздно достигают капилляра, по которому быстро “плывут” лейкоциты. По сигналу цитокинов в стенке капилляра активизируются пара белков — селектин и интегрин. Селектин притормаживает лейкоцит, а вместе с интегрином лейкоцит останавливается совсем. Затем стенка капилляра раздвигается, лейкоцит вырывается на свободу и устремляется по цитокиновому следу к месту воспаления.
Как видно, сигнал локальный и работает через градиент концентрации. Это очень типичный паттерн в живых организмах. Всё это работает без какой-либо координации из мозга или прочих важных центров. Самоорганизация в действии.
#5. Как макрофаг уничтожает бактерию?
Макрофаги — удивительные создания. Вероятнее всего они продукт симбиоза амёб и более развитых организмов (как наш). Первым делом макрофаг обнаруживает бактерию с помощью своих рецепторов или с помощью антител, которые любят облепливать бактерии. Что же потом? Желудка у него нет, как и ротового отверстия. Как быть?
Макрофаг окружает бактерию и поглощает её. Живая бактерия плавает в специальном пузырьке внутри макрофага и надо бы её уничтожить. Происходит это так. Внутри макрофага есть пузырьки с энзимами. Энзимы прекрасно разрушают белки, так что могут с лёгкостью разрушить и сам макрофаг. Поэтому хранить их приходится в пузырьках-лизосомах.
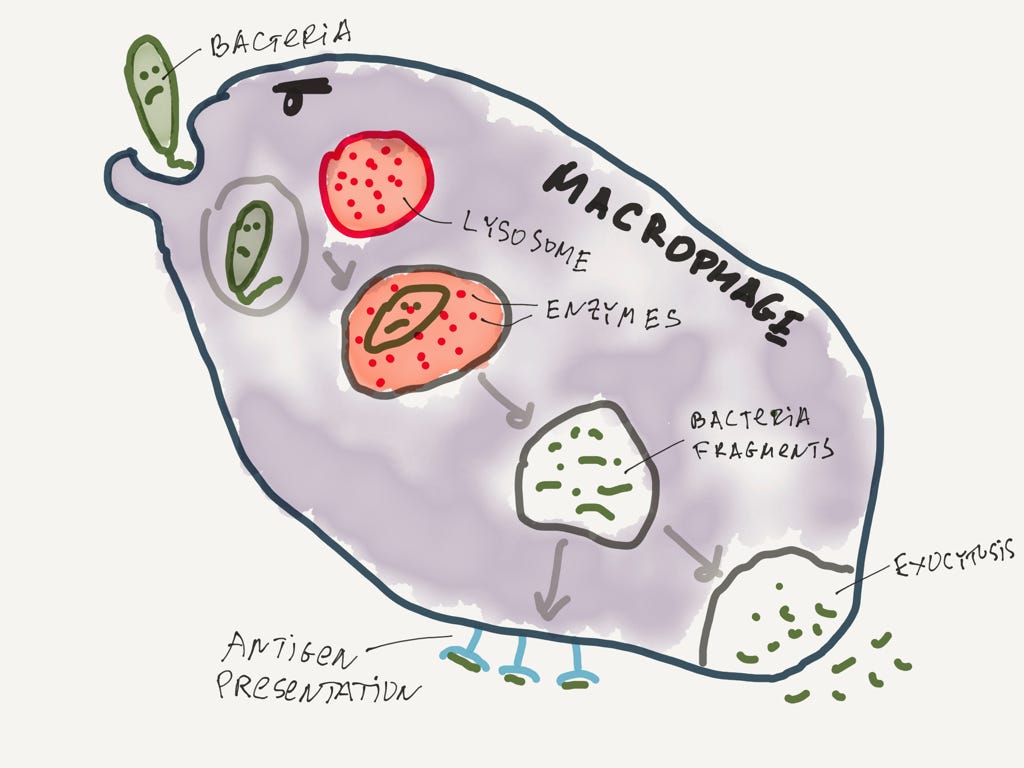 Суровый макрофаг на страже чистоты нашего организма.
Суровый макрофаг на страже чистоты нашего организма.
Думаю вы уже догадались, что произойдет с бактерией дальше. Всё, что осталось сделать—это слить пузырёк с бактерией вместе с лизосомой. Энзимы и бактерия оказываются вместе, после чего бактерия разрушается.
Надо сказать, что макрофаг не особенно любит что-то выбрасывать просто так. Поэтому разрушенные части выставляются на всеобщее обозрение, чтобы другие молекулы иммунной системы могли увидеть, что там сожрал макрофаг и среагировать на проблемы быстрее (самые сообразительные заметили, что макрофаг является APC, то есть антигенпрезентующей клеткой). Поразительная многозадачность!
#6. Как еще уничтожаются бактерии и клетки?
Помните систему комплемента? Настало время рассказать, как она работает.
- Сначала антитела прикрепляются к обреченной бактерии.
- Система комплемента устроена так, что любит прикрепляться к антителам, которые расположены рядом.
- После этого запускается довольно сложный процесс, в который мы не будем углубляться. В результате белки комплемента встраиваются в мембрану бактерии.
- Постепенно они перфорируют мембрану, и содержимое бактерии устремляется наружу. Бактерию разрывает, короче говоря.
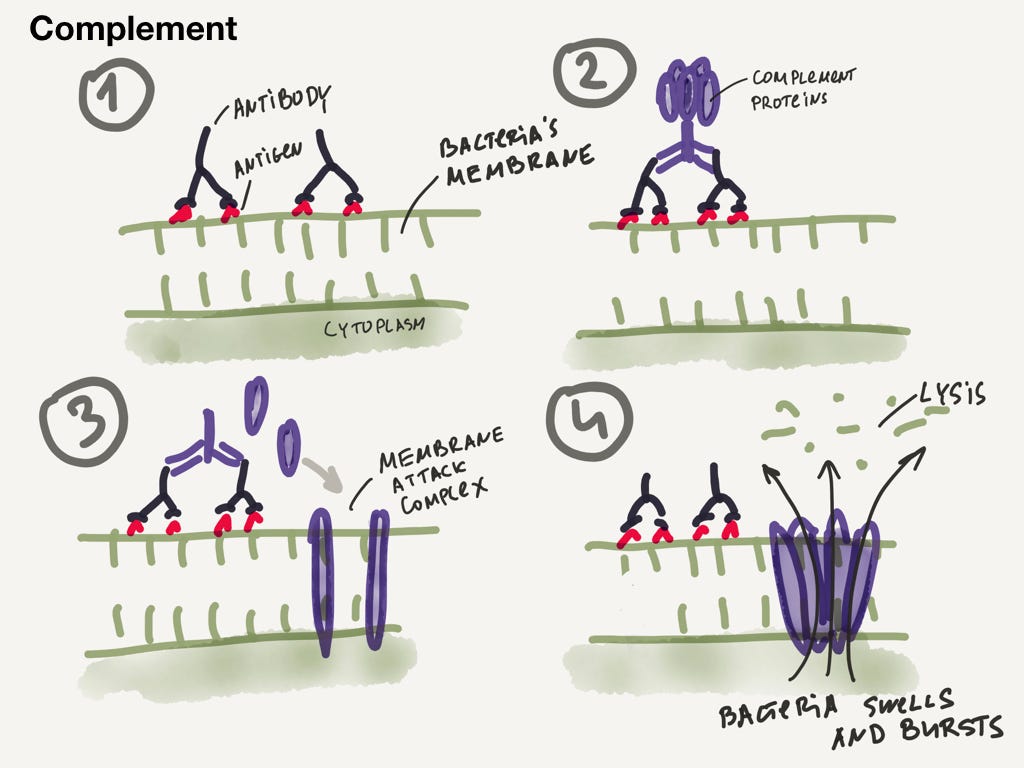 Система комплемента дырявит мембрану бактерии. Можно считать что антитела являются системой наведения для бомбардировок бактерий.
Система комплемента дырявит мембрану бактерии. Можно считать что антитела являются системой наведения для бомбардировок бактерий.
Антитела, как я уже говорил, опсонизируют бактерию, чем уменьшают её подвижность и делают крайне привлекательной для макрофагов.
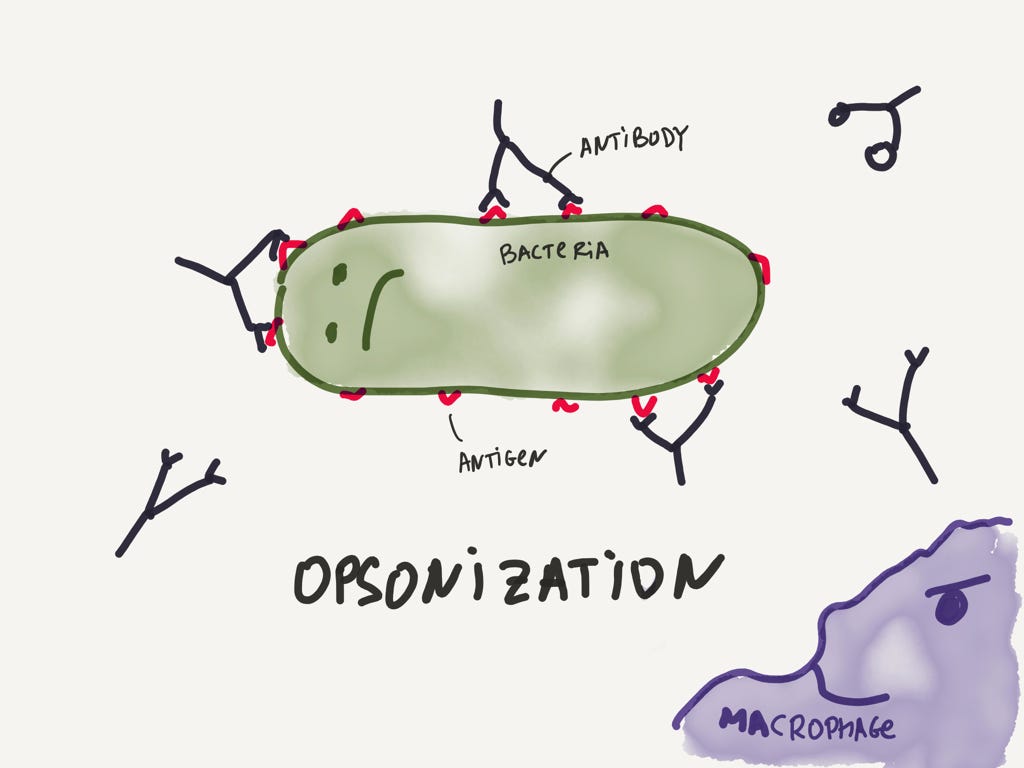 Недовольная бактерия облепленная антителами, на которую со злобным удовлетворением посматриваем суровый макрофаг.
Недовольная бактерия облепленная антителами, на которую со злобным удовлетворением посматриваем суровый макрофаг.
Давайте ещё посмотри на T-киллеров (это уже клетки адаптивной иммунной системы). T-киллеры работают очень элегантно. Например, у нас в клетке вирус. Она выставила куски вируса наружу и T-киллер благополучно прикрепился к этой клетке. Что дальше? Как её уничтожить?
Для начала T-киллер выбрасывает белок перфорин, который делает в мембране клетки дырку. Потом выбрасывается гранзим, который проникает в клетку через эту дыру.
Может быть вы слышали, что клетки могут запустить процесс самоубийства, который называется апоптоз. Собственно, гранзим и запускает этот процесс.
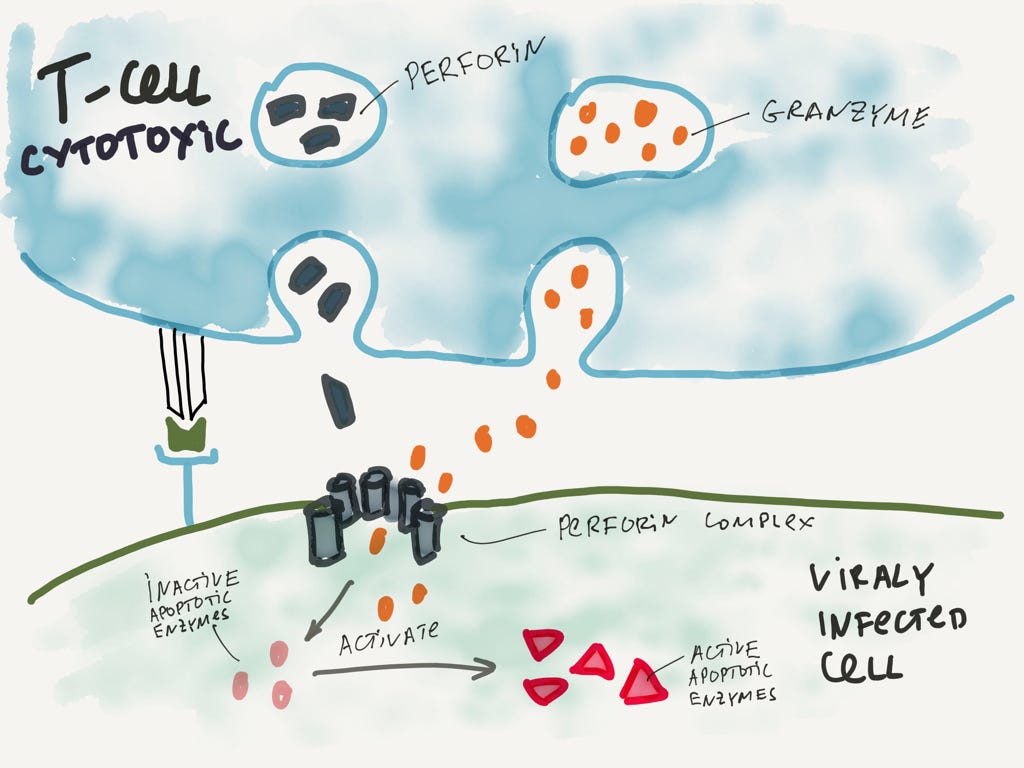 Процесс запуска апоптоза инфицированной клетки. В каждой клетке лежат энзимы, которые ждут своей активации, чтобы разрушить все вокруг.
Процесс запуска апоптоза инфицированной клетки. В каждой клетке лежат энзимы, которые ждут своей активации, чтобы разрушить все вокруг.
Фактически T-киллер приказывает клетке совершить самоубийство! Надо сказать, что апоптоз гораздо безопаснее для организма, чем какой-то другой процесс разрушения клетки, потому что в случае апоптоза вирусы внутри клетки уничтожаются, а в случае спонтанного разрушения благополучно могут выжить.
#7. Как работает память адаптивной иммунной системы?
Как вы знаете, организм каким-то образом запоминает перенесенные инфекции и потом реагирует на них гораздо быстрее. Как это происходит? За это отвечают B-лимфоциты.
Пока я рассказывал только о B-лимфоцитах, которые умеют вырабатывать антитела (plasma B-cell), но некоторая часть B-лимфоцитов превращается в клетки памяти (memory B-cell). Они несут на своей поверхности рецепторы, которые умеют распознавать данный антиген. Клетки памяти живут долго.
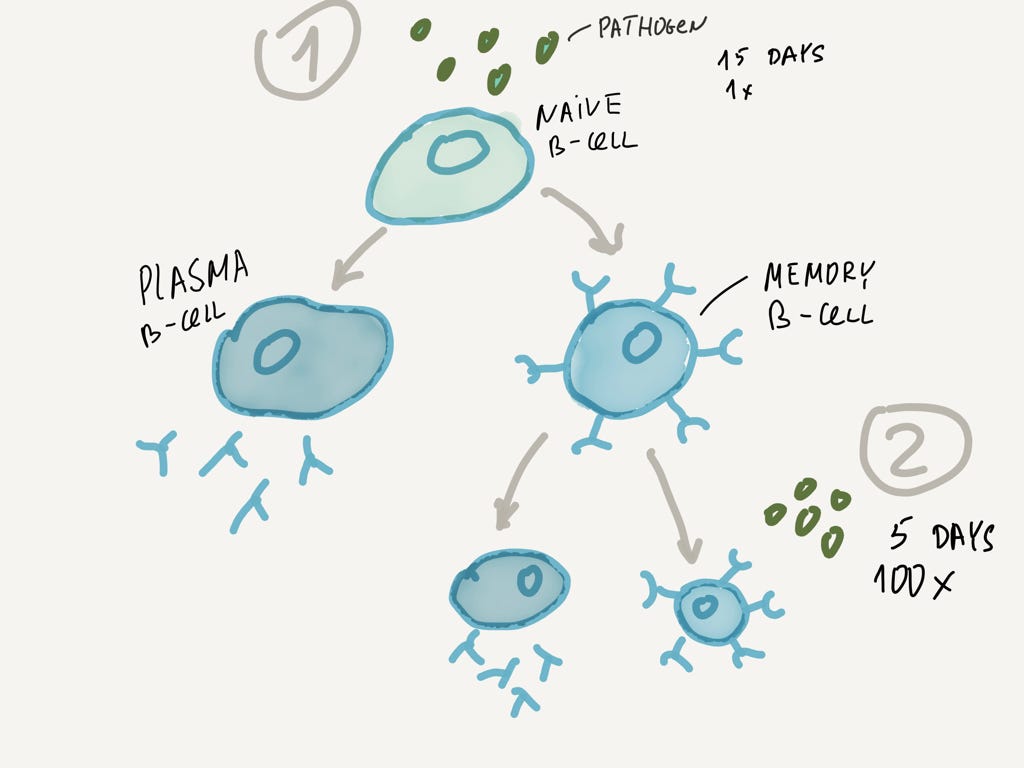 Наивный B-лимфоцит может превратиться либо в плазматическую клетку, либо в клетку памяти. Клетки памяти — это кеш нашей иммунной системы!
Наивный B-лимфоцит может превратиться либо в плазматическую клетку, либо в клетку памяти. Клетки памяти — это кеш нашей иммунной системы!
Представим, что в организм попал патоген, с которым мы уже имели дело. Его презентуют клетке памяти, она активируется, размножается и начинает производить антитела в гораздо больших количествах.
Например, если при первом иммунном ответе приличная концентрация антител достигается через 15 дней, то при повторном скорость выработки антител выше в 100 раз и уже через несколько дней концентрация достаточна для быстрой и сокрушительной победы.
#8. Зачем матери целуют своих детей?
Теперь вы, скорее всего, и сами сможете ответить на этот вопрос. Подумайте немного, прежде чем читать дальше.
У грудных детей не особенно хорошо работает адаптивная иммунная система, поэтому антитела они получают с молоком матери (в частности поэтому кормление грудью для детей крайне полезно, они меньше болеют).
Но как иммунной системе матери определить, с какими патогенами имеет дело ребёнок в данный момент времени? Поцелуй работает просто великолепно! После поцелуя в организм матери попадают патогены, которые есть у ребёнка. Иммунная система матери реагирует на них, memory B-cells активируются и вырабатывают большое количество нужных антител. Ребёнок сосет молоко вместе с антителами и успешно борется с патогенами.
Так что, мамы, почаще целуйте своих детей, пока кормите их грудью. Ну и потом тоже можно, правда на здоровье ребёнка это уже вряд ли повлияет.
Почти конец
Можно задать еще очень много интересных и важных вопросов:
- Как иммунная система борется с раком?
- Почему она не может эффективно распознавать раковые клетки?
- Как самые перспективные лекарства от рака связаны с иммунной системой?
- Как иммунные клетки учатся не убивать клетки собственного организма?
- Что бывает, когда это все же случается?
- Как организм борется с грибками?
Возможно, вам станет интересно и вы поглубже уйдёте в эту проблематику (или попросите меня написать продолжение). К сожалению, большинство хороших и относительно доступных материалов есть только на английском языке.
Такие дела.